
Образование накипи и ее влияние на работу двигателя
Вода в природе
Вода и примеси в ней. Вода, находящаяся в природе, всегда содержит примеси. Примеси эти могут быть растворимыми в виде различных солей, газов (кислород и углекислый газ) и других веществ, а также в виде нерастворимых твердых частиц, взмученных в воде. Вещества, не растворимые в воде и находящиеся в ней в тонкодисперсном состоянии, обычно называют механическими примесями. Количество этих примесей в воде непостоянно и может колебаться в широких пределах. Значительное повышение механических примесей происходит в периоды весенних паводков и дождливых сезонов.
Если частицы достаточно велики, то они оседают быстро. С уменьшением размера частиц осаждение их в воде происходит значительно медленнее.
В водопроводную сеть вода поступает осветленной, т. е. очищенной от механических примесей. Все же незначительное количество этих примесей в питьевой воде допускается. Механические примеси являются преимущественно минеральными веществами. Однако в воде Открытых водоемов могут находиться и органические вещества (продукты разложения растений), которые обычно придают воде желтоватый оттенок.
Вода с механическими примесями и органическими веществами, как правило, попадает в систему охлаждения двигателя лишь при заправке вне города из случайного источника. В некоторых грунтовых водах и в воде, загрязненной сточными водами, помимо кислорода и углекислого газа, могут находиться сероводород и аммиак в виде солей или в свободном состоянии. Все эти газы, растворенные в воде, следует отнести к веществам, вызывающим коррозию в системе охлаждения двигателя. Особенно агрессивными свойствами обладает сероводород.
Жесткость воды. В результате растворения солей вода содержит ионы натрия, калия, кальция, магния, железа и других металлов, а также анионы соляной, серной, угольной, кремниевой и других кислот. Важнейшим показателем качества воды является ее жесткость. Общая жесткость воды Ж0 определяется содержанием солей кальция и магния. Часть общей жесткости, обусловленная присутствием кислых солей угольной кислоты (бикарбонатов) кальция Са(НСО3)2 и магния Mg(HСО3)2, называется карбонатной жесткостью Жк. Все остальные соли кальция и магния составляют некарбонатную или постоянную жесткость Жнк. Таким образом, Ж0 = Жк+Жнк.
Жесткость воды по ГОСТ 6055-51 измеряется количеством миллиграммэквивалентов солей кальция и магния в 1 л воды (мгэкв/л) или количеством граммэквивалентов в 1 м3 (гэкв/м3). Таким образом, за единицу жесткости принято количество кальция, равное 20,04 мг, или количество магния, равное 12,16 мг в 1 л воды (или 20,04 г кальция или 12,16 г магния в 1 м3 воды). Если весовые количества кальция и магния в 1 л воды равны соответственно [Са2+] и [Mg2+], то общая жесткость воды будет равна
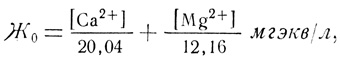
или
Ж0 = 0,0499 [Са2+] + 0,08223 [Mg2+] мгэкв/л.
Общее содержание солей в воде различных источников и ее жесткость могут значительно отличаться друг от друга. Ниже приведена жесткость различной воды, мгэкв/л:

Наиболее мягкая вода в реках: Печоре, Неве (до 6,5 мгэкв/л), Лене, Енисее (до 1,5 мгэкв/л), Оби, Иртыше, Кубани, Вятке, Северной Двине (до 3 мгэкв/л), Днепре, Оке (до 4 мгэкв/л). Вода средней жесткости - в реках: Амударье, Москве, Доне, Каме, Волге. Общая жесткость воды в морях находится в пределах 65-68 мгэкв/л, а в океанах до 130 мгэкв/л. Однако жесткость воды в реках изменяется в зависимости от времени года. Наименьшая жесткость имеет место весной в апреле или мае после интенсивного таяния снегов и льда, а максимальная наблюдается в период, предшествующий интенсивному весеннему таянию снегов.
|
ПОИСК:
|
© MOTORZLIB.RU, 2001-2020
При использовании материалов сайта активная ссылка обязательна:
http://motorzlib.ru/ 'Автомобилестроение, наземный транспорт и организация движения'
При использовании материалов сайта активная ссылка обязательна:
http://motorzlib.ru/ 'Автомобилестроение, наземный транспорт и организация движения'