
Физико-химические процессы образования накипи
Физико-химические процессы, происходящие при образовании накипи, можно разделить на две стадии. К первой следует отнести процессы, приводящие к возникновению первичных зародышей микрокристаллов твердой фазы, и ко второй - процессы роста этих зародышей, заканчивающиеся образованием плотных отложений.
Возникновение зародышей происходит за счет следующих основных процессов:
- разложения солей карбонатной жесткости при нагревании воды до 70° С и выше:
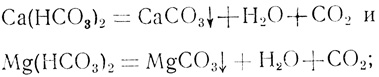
- кристаллизации сернокислого кальция (гипса) в результате уменьшения его растворимости при повышении температуры;
коагуляции кремниевой кислоты из коллоидного состояния.
Образовавшийся карбонат магния MgCО3 при длительном нагревании и нагреве выше 100°С вступает во взаимодействие с водою (подвергается гидролизу) с образованием сначала основной углекислой соли Mg2(OH)2CО3, а в дальнейшем и гидроокиси магния Mg(OH)2.
Следует помнить, что абсолютно нерастворимых веществ не существует. Есть только вещества практически нерастворимые, имеющие ничтожную растворимость, которой обычно на практике пренебрегают.
Для подавляющего большинства солей с повышением температуры растворимость увеличивается. Однако есть ряд таких соединений, у которых с повышением температуры растворимость уменьшается. К ним относят многие компоненты накипи, например, карбонат кальция и гидроокись магния. Это означает, что повышение температуры способствует лучшему и более полному выделению из воды накипеобразователей.
В системе охлаждения двигателя благоприятные физико-химические условия для образования накипи могут возникнуть:
- если в результате нагрева воды произойдут химические процессы, при которых образуются труднорастворимые соединения;
- при интенсивном испарении воды и доливе ее в систему охлаждения, в результате чего концентрация солей в растворе будет непрерывно увеличиваться;
- при понижении растворимости накипеобразователей, которое происходит при повышении температуры и при большой постоянной жесткости воды.
|
ПОИСК:
|
© MOTORZLIB.RU, 2001-2020
При использовании материалов сайта активная ссылка обязательна:
http://motorzlib.ru/ 'Автомобилестроение, наземный транспорт и организация движения'
При использовании материалов сайта активная ссылка обязательна:
http://motorzlib.ru/ 'Автомобилестроение, наземный транспорт и организация движения'